Содержание
Учимся определять полярность автомобильного аккумулятора
Мне, человеку, связавшему свою пока еще короткую журналистскую карьеру с жизнеописаниями хитрых и своенравных аккумуляторных батарей, часто снится один и тот же кошмар.
Вот я прихожу в наш магазин «Автоша», вот выбираю батарейку нужной емкости, нужных габаритных размеров. Внимательно смотрю на параметры пускового тока – беру аккум с максимальными. Приезжаю домой, открываю капот своего авто и…
Даже не знаю, как описать этот ужас. Длины токоприемных проводов не хватает до клемм! В этот момент я понимаю, что НЕ ОБРАТИЛ ВНИМАНИЯ НА ПОЛЯРНОСТЬ аккумулятора! После такого осознания я немедленно просыпаюсь – прерывисто дыша и стирая со лба ледяной пот.
Эти кошмарные видения и натолкнули меня на мысль обезопасить вас, уважаемые читатели, от подобных катастроф в реальной жизни. Итак, какой же она может быть, эта коварная полярность.
Батареи для легковушек: реальные и условные виды полярности
Всего в аккумуляторной промышленности существует шесть типов компоновки и соединения между собой ячеек аккумуляторной батареи. Однако, большинство из них встречаются очень редко и рассматривать их под микроскопом мы не будем. Обратимся к самым распространенным и способам, как можно отличить их друг от друга.
Однако, большинство из них встречаются очень редко и рассматривать их под микроскопом мы не будем. Обратимся к самым распространенным и способам, как можно отличить их друг от друга.
Все типы полярности автомобильного аккумулятора
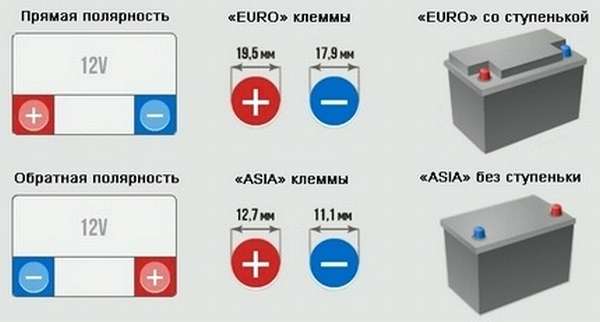
Перво-наперво, возьмемся за батарейки для легковых автомобилей. Берем аккумулятор и разворачиваем его к себе «лицом», то есть, этикеткой. Клеммы в этом случае будут находиться ближе к нам, на «макушке» нашего АКБ. Положительная (рядом с ней нарисован «+») находится справа, а минусовая(«-») слева? Перед вами аккумулятор с «обратной», по-другому — с «европейской» полярностью, которую часто обозначают «0».
Схема обратной полярности автомобильного аккумулятора
Если же положительный токовывод находится слева, а отрицательный – справа, то перед вами батарейка с полярностью «1» — «прямой» или «российской».
Схема прямой полярности автомобильного аккумулятора
Кстати, люди не сведущие зачастую говорят о некой «азиатской» полярности. На самом деле, речь идет об аккумуляторах, изготавливаемых для азиатских авто.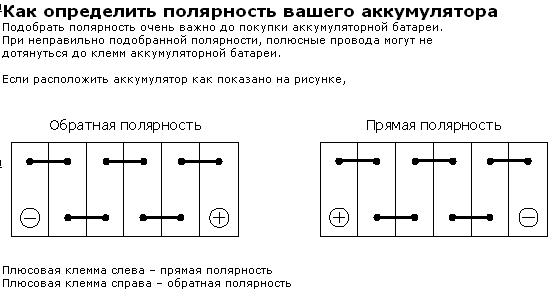 Они имеют «европейскую» полярность, и отличаются только габаритами ( «квадратнее» коллег из Европы, США и России) и видом токовыводов. На обычных батареях клеммы слегка «утоплены» и находятся в нишах, а у «азиатских» они – на ровной поверхности. Кроме того, токовыводы «азиатов» заметно тоньше тех, что устанавливаются на батареях со всего мира.
Они имеют «европейскую» полярность, и отличаются только габаритами ( «квадратнее» коллег из Европы, США и России) и видом токовыводов. На обычных батареях клеммы слегка «утоплены» и находятся в нишах, а у «азиатских» они – на ровной поверхности. Кроме того, токовыводы «азиатов» заметно тоньше тех, что устанавливаются на батареях со всего мира.
Ну и, наконец, замолвим словечко еще об одном виде полярности легковых автомобилей – «американской полярности». Она встречается у батарей, предназначенных для автомобилей, произведенных на территории США. Клеммы у АКБ с «американской полярностью» находятся на фронтальной стороне, над лицевой этикеткой.
А как у грузовиков?
Клеммы на аккумуляторах для грузовых авто расположены по одной из коротких сторон батареи. Развернем АКБ этой самой стороной с клеммами к себе (можно мысленно, среди нас не все уродились гераклами). Слева «плюс» — полярность «3» — «европейская»/«обратная». Слева «минус» — значит полярность у батареи «4» — «прямая»/«российская».
Схема обратной полярности аккумулятора для грузового транспорта
Схема прямой полярности аккумулятора для грузового транспорта
Кроме того, могут встречаться грузовые аккумуляторы с полярностью «2» — клеммы у таких аккумуляторов расположены по диагонали.
Включаем Шерлока: что, если «плюс» не обозначен?
Конечно, производители стараются сделать аккумуляторы простыми и понятными для каждого пользователя. Положительные токовыводы отмечаются сразу бросающимися в глаза знаками «+» и красным цветом, отрицательные – не менее крупными «-» и синим/черным цветом. Но теоретически мы можем однажды оказаться наедине с батарейкой без всякой маркировки. Или с такой, маркировку которой уничтожили вредители, варвары, стихийные бедствия… Что делать тогда? Первым делом, мои пытливые друзья, необходимо измерить диаметр токовыводов. Диаметр положительных всегда на пару миллиметров больше диаметра отрицательных. У «европейцев» вывод плюсового электрода имеет толщину 19,5 миллиметров, а минусовая клемма — 17,9.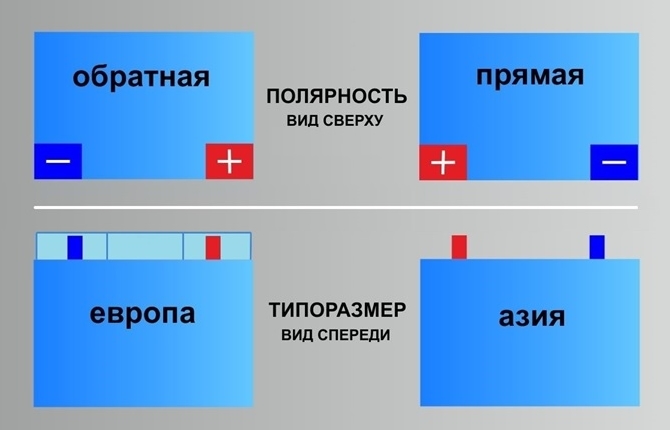 У азиатов – 12,7 и 11,1 соответственно.
У азиатов – 12,7 и 11,1 соответственно.
Данный метод определения плюсов-минусов тоже не дал результата? Что ж, теперь нам поможет только учебник занимательной химии для самых маленьких. К клеммам батареи без опознавательных знаков необходимо прикрепить медные проводки. Оголенные концы проводков вводим в картофельный срез на расстоянии 5-10 мм друг от друга. Ждем 1-2 минуты. Эврика! Картофель вокруг «положительного» проводка слегка позеленеет.
Под рукой нет картошки, но есть, к примеру, лимонная или любая другая слабая кислота? Пожалуйста! Разводим ее в стакане воды, погружаем в него проводки от обеих клемм так, чтобы они не соприкасались. Вокруг «отрицательного» проводка начнется бурное выделение пузырьков газа.
Теперь, уважаемые читатели, когда вы знаете о «минусах» и «плюсах» аккумуляторов практически все, кошмары меня, надеюсь, оставят. А за вас – никогда не возьмутся, ни во сне, ни наяву!
Как определить полярность аккумулятора?
Главная
» Полезные статьи
» Как определить полярность аккумулятора?
Опубликовано: 12 Сентября 2016 года
Автомобильный аккумулятор, как и любой элемент питания, например, «пальчиковая» батарейка, имеет определенную полярность («+» плюс и «-» минус). Важно при подборе новой аккумуляторной батареи для своего автомобиля правильно определить расположение плюсовой клеммы. Ведь если вы перепутаете полярность стартерного аккумулятора, вам скорее всего не удастся его установить, и впоследствии, возникнут проблемы с заменой уже нового аккумулятора.
Важно при подборе новой аккумуляторной батареи для своего автомобиля правильно определить расположение плюсовой клеммы. Ведь если вы перепутаете полярность стартерного аккумулятора, вам скорее всего не удастся его установить, и впоследствии, возникнут проблемы с заменой уже нового аккумулятора.
Немного поразмыслив, вы скажете – «Ничего страшного, я разверну аккумулятор вокруг его оси, и полярность сразу поменяется». Это так, НО…
В настоящее время все стремятся сэкономить, производители автомобилей не исключение… Каждый сантиметр современной иномарки стоит не мало денег, в том числе и токопроводящие элементы (провода).
Конструкторы все просчитали, все в «притирочку», проводки ровно столько, сколько необходимо для предусмотренного аккумулятора. И если вы купили аккумулятор неправильной полярности и предполагаете развернуть его в месте установки, то учитывайте особенности конструкции стартерной аккумуляторной батареи, в частности то, что клеммы расположены по краю крышки корпуса АКБ, и если вы развернете аккумулятор, те самые клеммы окажутся с противоположной стороны.
И вот вы развернули аккумулятор, клеммы соответственно сместились в противоположную сторону, а конструкторы вашего авто на это не рассчитывали, и длинны силовых проводов автомобиля попросту не хватит для подключения аккумулятора.
Раньше конструкторы автомобилей не были такими экономными, и зачастую авто старого образца имеет небольшой запас длины токопроводящих элементов (проводки), поэтому владельцам этих авто подойдут аккумуляторы с любой полярностью.
И все же, у вас современный автомобиль, и вам нужно правильно подобрать аккумулятор с определенной полярностью.
Начнем с простого.
Для того, что бы определить полярность аккумулятора, предусмотренного производителем на ваш автомобиль, достаточно просто правильно посмотреть на него. Итак, вы смотрите на аккумулятор, из-за конструкционных особенностей подкапотного пространства, он на разных машинах может размещаться по-разному.
Смотреть на аккумулятор предпочтительней с верхнего ракурса. На стандартных АКБ плюсовая и минусовая клеммы расположены по длинной стороне корпуса батареи в правом и левом углах.
Осталось дело за малым, расположите аккумуляторную батарею таким образом, чтобы углы, в которых находятся клеммы, были ближе к вашему лицу.
Отличие прямой и обратной полярности автомобильного аккумулятора:
Если смотреть сверху:
Правильно:
Неправильно:
Вы сразу задумались, как это проблематично отключить от аккумулятора провода, и после этого вертеть тяжелый «свинцовый ящик»… Этого, конечно же, делать не нужно, достаточно просто подойти (расположить себя) с правильной стороны относительно источника питания вашего автомобиля.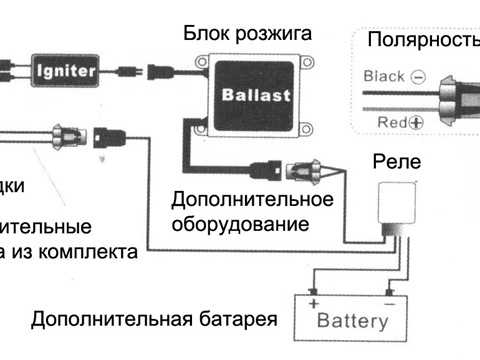
И вот мы «ПРАВИЛЬНО» смотрим на аккумулятор, и внимательно изучаем:
1. Если вы не отключали АКБ, и он все еще находится на своем месте, то, как правило, на современных авто, токопроводящие элементы (попросту провода с «наклемниками») имеют разные цвета. Клемма, к которой подключен провод красного цвета, и есть плюсовая.
2. Присмотритесь к тем самым углам крышки аккумулятора, в которых находятся клеммы, в 99% случаях в одном из этих углов вы увидите маркировку «+». Вы нашли плюсовую клемму.
3. Бывают и тяжелые случаи: Вы все тщательно осмотрели и все же не нашли никаких знаков указывающих на полярность аккумулятора. Не отчаивайтесь. Как правило, плюсовая клемма отличается от минусовой по размеру. Можно заметить и невооруженным глазом, что одна из клемм «толще», вот она и есть плюсовая.
Можно заметить и невооруженным глазом, что одна из клемм «толще», вот она и есть плюсовая.
Вот и все – вы определили, что плюсовая клемма находится с правой стороны – значит у вас аккумулятор с «обратной (0) R+» полярностью, если же «+» слева – значит АКБ с «прямой (1) L+» полярностью.
Ну а если вы все же столкнулись со сложностями в определении полярности на аккумуляторе для своего автомобиля или попросту не хотите вникать в эти тонкости, менеджеры интернет-магазина akb4you.com с радостью предоставят консультацию.
Большой выбор качественных аккумуляторов для авто на сайте http://akb4you.com
Полярные и неполярные связи и молекулы
В этом уроке по химии мы объясним разницу между полярными связями и неполярными связями . Затем мы расскажем вам определение полярной молекулы и что такое неполярная молекула . И последнее, но не менее важное: вы узнаете, что такое дипольный момент .
И последнее, но не менее важное: вы узнаете, что такое дипольный момент .
Что означают полярный и неполярный?
Проще говоря, полярный означает противоположно заряженный, а неполярный означает одинаково заряженный. Ковалентные связи могут быть полярными и неполярными. Чтобы понять разницу между полярными и неполярными связями, важно понять электроотрицательность.
Что такое электроотрицательность?
Электроотрицательность — это мера того, насколько сильно атом хочет соединиться с другим атомом. Электроотрицательность увеличивается слева направо и вниз по каждому столбцу периодической таблицы. Шкала Полинга описывает электроотрицательность элемента со шкалой от 0,7 до 4. Фтор является наиболее электроотрицательным элементом с электроотрицательностью 4. Цезий является наименее электроотрицательным элементом с электроотрицательностью 0,7.
Что делает связь полярной?
Полярная связь — это тип ковалентной связи.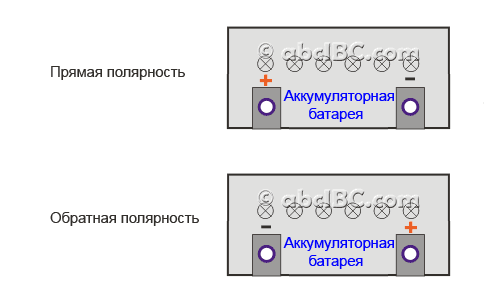 Связь между двумя или более атомами является полярной, если атомы имеют значительно разные электроотрицательности (> 0,4). Полярные связи не разделяют электроны поровну, а это означает, что отрицательный заряд электронов неравномерно распределяется в молекуле. Это вызывает дипольный момент. Дипольный момент возникает, когда один конец связи положительный, а другой конец отрицательный. Классическим примером полярной связи является связь в воде между водородом и кислородом. Связь классифицируется как полярная связь, потому что она имеет большую разность электроотрицательностей 1,4. Электроны в водороде больше притягиваются к электронам в кислороде, потому что кислород более электроотрицательный.
Связь между двумя или более атомами является полярной, если атомы имеют значительно разные электроотрицательности (> 0,4). Полярные связи не разделяют электроны поровну, а это означает, что отрицательный заряд электронов неравномерно распределяется в молекуле. Это вызывает дипольный момент. Дипольный момент возникает, когда один конец связи положительный, а другой конец отрицательный. Классическим примером полярной связи является связь в воде между водородом и кислородом. Связь классифицируется как полярная связь, потому что она имеет большую разность электроотрицательностей 1,4. Электроны в водороде больше притягиваются к электронам в кислороде, потому что кислород более электроотрицательный.
Что делает связь неполярной?
Неполярные связи также относятся к типу ковалентных связей. В отличие от полярных связей, неполярные связи делят электроны поровну. Связь между двумя или более атомами является неполярной, если атомы имеют одинаковую электроотрицательность или разность электроотрицательностей менее 0,4. Примером неполярной связи является связь в хлоре. Хлор содержит два атома хлора. Электроны делятся поровну, потому что разница электроотрицательностей между двумя атомами равна нулю.
Примером неполярной связи является связь в хлоре. Хлор содержит два атома хлора. Электроны делятся поровну, потому что разница электроотрицательностей между двумя атомами равна нулю.
Что такое полярные молекулы?
В химии определение полярной молекулы — это молекула, которая имеет заряд на одной стороне молекулы, который не компенсируется. Он имеет область частичного заряда. Один конец слегка положительный, другой конец слегка отрицательный. Обычно они асимметричны, с неравномерным распределением электронов.
Полярные молекулы могут иметь ионные или полярные ковалентные связи. Молекула с двумя полюсами называется диполем . Когда вы измеряете величину полярности молекулы, результат называется 9.0003 дипольный момент .
Если молекула неполярна, то молекулы либо поровну делят электроны, т.е. они имеют неполярную связь или полярные связи симметричны в случае двуокиси углерода или четыреххлористого углерода. В этих молекулах есть диполи, но они компенсируются из-за симметрии.
Полярные молекулы имеют тенденцию слипаться и выстраиваться в группы, что влияет на свойства полярных соединений, таких как вода. Молекулы воды могут фактически выстраиваться под действием электростатической силы. Кроме того, полярные растворители склонны растворять полярные растворенные вещества, а неполярные растворители растворяют неполярные растворенные вещества.
Примеры полярных молекул
Является ли HF полярным?
Да, плавиковая кислота HF является полярной из-за большой разницы в электроотрицательности водорода и фтора. Молекула является полярно-ковалентной.
Является ли вода полярной молекулой?
Да, из-за изогнутой несимметричной формы молекулы. К атомам кислорода притягивается больше электронов, что приводит к суммарному заряду.
Является ли ацетон полярным или неполярным?
Из-за карбонильной группы ацетон является несколько полярной молекулой. Существуют разные степени полярности, и ацетон менее полярен, чем вода, потому что только часть молекулы ацетона имеет полярную связь.
Подробнее примеры полярных молекул
диоксид серы SO 2 , аммиак NH 3 , Carbon Oxyde Co, этанол C 2 H 5 OH, Methanol CH 3 Oh, Hydrogen Wydrogen Hydrogen. S, хлорметан CH 3 Cl, озон O3, трихлорид фосфора (поскольку он имеет тригонально-пирамидальную геометрию) PCl 3
Неполярные молекулы
В неполярной молекуле не образуются положительные или отрицательные полюса. Любые заряды распределяются равномерно по молекуле. Неполярные молекулы обычно симметричны, как тетраэдрическая молекула четыреххлористого углерода. Другим примером является трифторид бора, который является тригонально-плоским. В симметричных молекулах дипольные заряды компенсируются.
Неполярные молекулы обычно хорошо растворяются в неполярных растворителях, но не растворяются в воде.
Примеры неполярных молекул
Является ли диоксид углерода полярным?
Нет, CO 2 не является полярным, хотя связи полярны.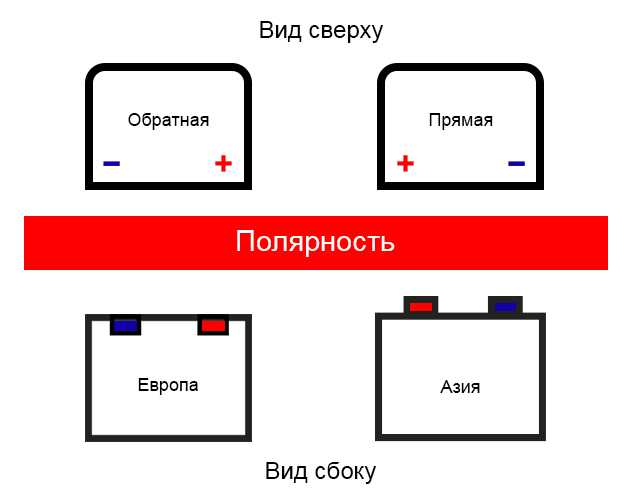 Из-за линейной симметрии молекулы отрицательные заряды вокруг атомов кислорода компенсируются.
Из-за линейной симметрии молекулы отрицательные заряды вокруг атомов кислорода компенсируются.
Является ли HCl полярной или неполярной?
Поскольку хлор более электроотрицателен, чем водород, соляная кислота HCl образует полярную связь и, следовательно, является полярной молекулой. Не существует симметрии, которая могла бы компенсировать дипольный заряд.
Дополнительные примеры неполярных молекул
Бензол C 6 H 6 , Метан CH 4 , Четыреххлористый углерод CCl 4 , Трифторид бора (поскольку он имеет тригонально-плоскую геометрию) гексан C 6 H 14 , азот N 2
Наша новая интерактивная периодическая таблица
Лучший способ просмотреть свойства и тенденции элементов, включая электроотрицательность, — это наша новая супер-крутая интерактивная периодическая таблица. Он имеет удивительные цвета, и вы можете просмотреть десятки свойств и увидеть статьи обо всех элементах!
Topics Covered in Other Articles
- Ionic vs Covalent bonds
- Molecule vs Compound
- Acid-Base Chemistry
- Polar-Covalent Bonds
Cool Chemistry Video that is NOT about Polar Bonds
youtube.com/embed/5lDmDyql2Zk?feature=oembed&enablejsapi=1&origin=https://chemistrytalk.org» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»> We love chemistry experiments так много, что мы выполнили их кучу и сделали это видео — и случайно выбрали эту статью, чтобы вставить видео. Смотрите, это действительно круто! Это не имеет прямого отношения к полярным и неполярным связям. И подписывайтесь на наш канал.
Подробнее
- Йод является обычной добавкой к лекарствам из-за его не -полярного свойства.
3.5.0: Электроотрицательность и полярность — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 210716
Цели обучения
- Дать определение электроотрицательности и оценить полярность ковалентных связей
youtube.com/embed/PVL24HAesnc?start=000&end=202&vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
Видео \(\PageIndex{1}\): Предварительный просмотр роли электроотрицательности в молекулярной полярности.
Electronegativity Review
Является ли связь неполярной или полярной ковалентной, определяется свойством связывающих атомов, называемым электроотрицательностью. Электроотрицательность — это мера тенденции атома притягивать к себе электроны (или плотность электронов). Он определяет, как общие электроны распределяются между двумя атомами в связи. Чем сильнее атом притягивает электроны своих связей, тем больше его электроотрицательность. Электроны в полярной ковалентной связи смещаются в сторону более электроотрицательного атома; таким образом, более электроотрицательным является атом с частичным отрицательным зарядом. Чем больше разница в электроотрицательности, тем более поляризовано распределение электронов и тем больше парциальные заряды атомов.
На рисунке \(\PageIndex{1}\) показаны значения электроотрицательности элементов, предложенные одним из самых известных химиков двадцатого века Линусом Полингом. Как правило, электроотрицательность увеличивается слева направо по периоду в периодической таблице и уменьшается по группе. Таким образом, неметаллы, расположенные вверху справа, обычно имеют самую высокую электроотрицательность, причем фтор является самым электроотрицательным элементом из всех (EN = 4,0). Металлы, как правило, менее электроотрицательны, а металлы группы 1 имеют самую низкую электроотрицательность. Обратите внимание, что благородные газы исключены из этого рисунка, потому что эти атомы обычно не делят электроны с другими атомами, поскольку они имеют полную валентную оболочку. (Хотя соединения благородных газов, такие как XeO 2 существуют, они могут образовываться только в экстремальных условиях и поэтому не вписываются в общую модель электроотрицательности.)
значения, полученные Полингом, следуют предсказуемым периодическим тенденциям с более высокой электроотрицательностью в верхнем правом углу периодической таблицы.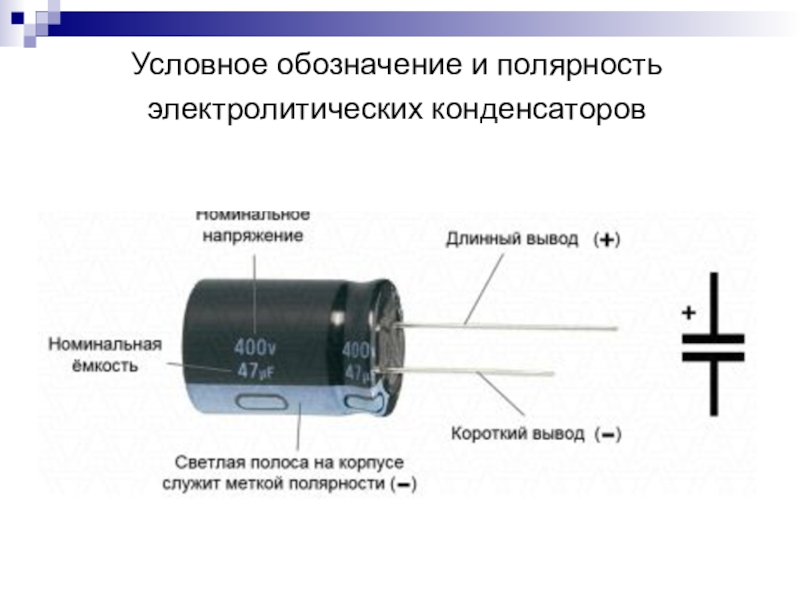
Лайнус Полинг
Лайнус Полинг — единственный человек, получивший две неразделенные (индивидуальные) Нобелевские премии: одну по химии в 1954 за его работу о природе химических связей и один за мир в 1962 году за его противодействие оружию массового уничтожения. Он разработал множество теорий и концепций, лежащих в основе нашего нынешнего понимания химии, включая электроотрицательность и резонансные структуры.
Лайнус Полинг (1901–1994) внес важный вклад в область химии. Он также был видным активистом, освещавшим вопросы, связанные со здоровьем и ядерным оружием.
Полинг также внес свой вклад во многие другие области, помимо химии. Его исследования серповидноклеточной анемии выявили причину заболевания — наличие генетически унаследованного аномального белка в крови — и проложили путь к области молекулярной генетики. Его работа также сыграла ключевую роль в сдерживании испытаний ядерного оружия; он доказал, что радиоактивные осадки в результате ядерных испытаний представляют опасность для здоровья населения.
Электроотрицательность и сродство к электрону
Мы должны быть осторожны, чтобы не путать электроотрицательность и сродство к электрону. Сродство элемента к электрону — измеримая физическая величина, а именно энергия, выделяющаяся или поглощаемая при присоединении электрона изолированным атомом газовой фазы, измеряемая в кДж/моль. С другой стороны, электроотрицательность описывает, насколько сильно атом притягивает электроны в связи. Это безразмерная величина, которая рассчитывается, а не измеряется. Полинг получил первые значения электроотрицательности, сравнив количество энергии, необходимое для разрыва различных типов связей. Он выбрал произвольную относительную шкалу от 0 до 4,9.0013
Электроотрицательность и тип связи
Абсолютное значение разности электроотрицательностей (ΔEN) двух связанных атомов обеспечивает приблизительную меру ожидаемой полярности связи и, следовательно, типа связи. Когда разница очень мала или равна нулю, связь является ковалентной и неполярной. Когда он большой, связь является полярной ковалентной или ионной. Абсолютные значения разностей электроотрицательностей между атомами в связях H–H, H–Cl и Na–Cl равны 0 (неполярные), 0,9 (полярные ковалентные) и 2,1 (ионные) соответственно. Степень, в которой электроны разделены между атомами, варьируется от полностью равного (чистая ковалентная связь) до полного отсутствия (ионная связь). На рисунке \(\PageIndex{2}\) показана зависимость между разницей электроотрицательностей и типом связи.
Когда он большой, связь является полярной ковалентной или ионной. Абсолютные значения разностей электроотрицательностей между атомами в связях H–H, H–Cl и Na–Cl равны 0 (неполярные), 0,9 (полярные ковалентные) и 2,1 (ионные) соответственно. Степень, в которой электроны разделены между атомами, варьируется от полностью равного (чистая ковалентная связь) до полного отсутствия (ионная связь). На рисунке \(\PageIndex{2}\) показана зависимость между разницей электроотрицательностей и типом связи.
Рисунок \(\PageIndex{2}\): По мере увеличения разницы электроотрицательностей между двумя атомами связь становится более ионной.
На рисунке \(\PageIndex{4}\) показана грубая аппроксимация различий электроотрицательности, связанных с ковалентными, полярными ковалентными и ионными связями. Однако эта таблица является лишь общим руководством со многими исключениями. Например, атомы H и F в HF имеют разность электроотрицательностей 1,9, а атомы N и H в NH 3 разница составляет 0,9, однако оба этих соединения образуют связи, которые считаются полярными ковалентными. Точно так же атомы Na и Cl в NaCl имеют разность электроотрицательностей 2,1, а атомы Mn и I в MnI 2 имеют разность 1,0, однако оба эти вещества образуют ионные соединения.
Точно так же атомы Na и Cl в NaCl имеют разность электроотрицательностей 2,1, а атомы Mn и I в MnI 2 имеют разность 1,0, однако оба эти вещества образуют ионные соединения.
Лучшее руководство по ковалентному или ионному характеру связи — рассмотреть типы вовлеченных атомов и их относительное положение в периодической таблице. Связи между двумя неметаллами обычно ковалентны; связь между металлом и неметаллом часто ионная.
Некоторые соединения содержат как ковалентные, так и ионные связи. Атомы в многоатомных ионах, таких как OH – , \(\ce{NO3-}\) и \(\ce{Nh5+}\), удерживаются вместе полярными ковалентными связями. Однако эти многоатомные ионы образуют ионные соединения, соединяясь с ионами противоположного заряда. Например, нитрат калия KNO 3 содержит катион K + и многоатомный анион \(\ce{NO3-}\). Таким образом, связь в нитрате калия ионная, возникающая в результате электростатического притяжения между ионами K + и \(\ce{NO3-}\), а также ковалентная между атомами азота и кислорода в \(\ce{NO3-}\).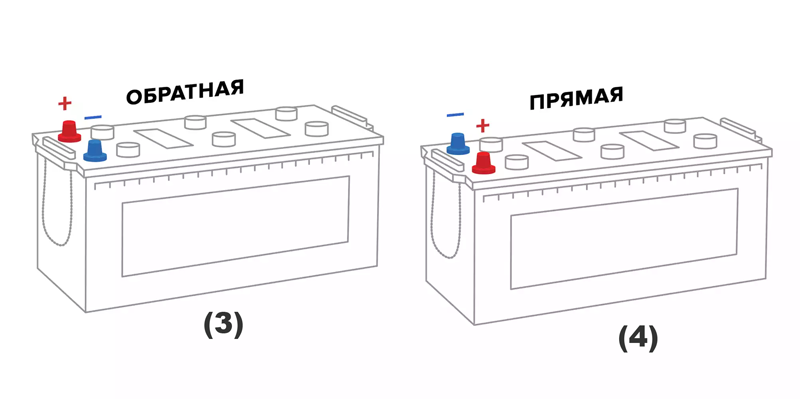
Пример \(\PageIndex{1}\): электроотрицательность и полярность связи
Полярность связи играет важную роль в определении структуры белков. Используя значения электроотрицательности в таблице A2, расположите следующие ковалентные связи — все они обычно встречаются в аминокислотах — в порядке возрастания полярности. Затем обозначьте положительные и отрицательные атомы, используя символы δ+ и δ–:
C–H, C–N, C–O, N–H, O–H, S–H
Раствор
Полярность этих связей возрастает по мере увеличения абсолютной величины разности электроотрицательностей. Атом с обозначением δ- является более электроотрицательным из двух. В таблице \(\PageIndex{1}\) эти связи показаны в порядке возрастания полярности.
 «>
«>Упражнение \(\PageIndex{1}\)
Силиконы представляют собой полимерные соединения, содержащие, среди прочего, следующие типы ковалентных связей: Si–O, Si–C, C–H и C–C. Используя значения электроотрицательности на рисунке \(\PageIndex{3}\), расположите связи в порядке возрастания полярности и обозначьте положительные и отрицательные атомы символами δ+ и δ–.
Используя значения электроотрицательности на рисунке \(\PageIndex{3}\), расположите связи в порядке возрастания полярности и обозначьте положительные и отрицательные атомы символами δ+ и δ–.
Ответ
Подробнее
Видео \(\PageIndex{2}\): Вода — уникальная полярная молекула.
Сводка
Видео \(\PageIndex{3}\): Обзор электроотрицательности.
Ковалентные связи образуются, когда электроны распределяются между атомами и притягиваются ядрами обоих атомов. В чисто ковалентных связях электроны распределены поровну. В полярных ковалентных связях электроны распределяются неравномерно, поскольку один атом оказывает на электроны более сильное притяжение, чем другой. Способность атома притягивать пару электронов в химической связи называется его электроотрицательностью. Разница в электроотрицательности между двумя атомами определяет, насколько полярной будет связь. В двухатомной молекуле с двумя одинаковыми атомами нет разницы в электроотрицательности, поэтому связь неполярная или чисто ковалентная. Когда разница электроотрицательностей очень велика, как в случае между металлами и неметаллами, связь характеризуется как ионная.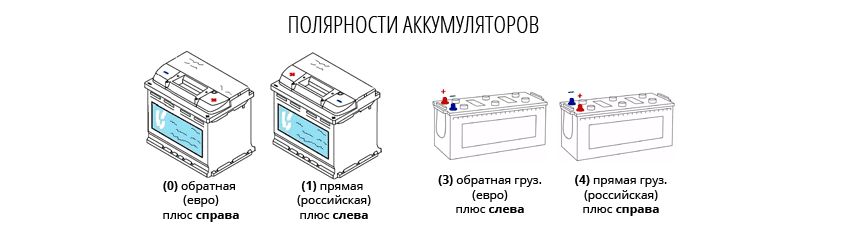
Глоссарий
- длина соединения
- расстояние между ядрами двух связанных атомов, при котором достигается наименьшая потенциальная энергия
- ковалентная связь
- образуется, когда электроны делятся между атомами
Связь
- электроотрицательность
- склонность атома притягивать к себе электроны в связи
- полярная ковалентная связь
- ковалентная связь между атомами различной электроотрицательности; ковалентная связь с положительным концом и отрицательным концом
- чистая ковалентная связь
- (также неполярная ковалентная связь) ковалентная связь между атомами с одинаковой электроотрицательностью
Авторы и ссылки
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф. Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.


